سرطان کولورکتال (Colorectal Cancer) یکی از شایعترین و خطرناکترین انواع سرطان در سراسر جهان است. این بیماری نتیجه تعامل پیچیدهای بین عوامل ژنتیکی و محیطی است که منجر به ایجاد رفتارهای سرطانی در سلولهای اپیتلیال روده بزرگ میشود. در این مقاله، به بررسی دقیق پاتوفیزیولوژی سرطان کولورکتال، از نقش جهشهای ژنتیکی تا تأثیر محیط تومور و میکروبیوتای روده میپردازیم.
۱. ناپایداری ژنتیکی و اپیژنتیکی: نقطه شروع سرطان
ناپایداری ژنومی و اپیژنومی
بیشتر ضایعات نئوپلاستیک اولیه در روده بزرگ (مانند کانونهای کریپت غیرطبیعی، آدنومها و پولیپهای سرشتی) از دست دادن پایداری ژنومی و اپیژنومی را نشان میدهند. این ناپایداری باعث تسریع تجمع جهشها و تغییرات اپیژنتیکی میشود که در نهایت منجر به تبدیل بدخیم سلولهای روده میشود.
گسترش کلونال
تجمع جهشها منجر به گسترش کلونال سلولهایی میشود که بیشترین رفتارهای تهاجمی و بدخیم را دارند. این فرآیند نقش محوری در شروع و پیشرفت سرطان کولورکتال ایفا میکند.
۲. سلولهای بنیادی: منشأ سرطان
فرضیه سلولهای بنیادی
مدل غالب نشان میدهد که سرطان کولورکتال از سلولهای بنیادی یا سلولهای شبه بنیادی واقع در پایه کریپتهای روده بزرگ نشأت میگیرد. جهشها در ژنهای اونکوژن و ژنهای سرکوبگر تومور در این سلولها منجر به تشکیل سلولهای بنیادی سرطانی میشود که برای شروع و حفظ تومور ضروری هستند.
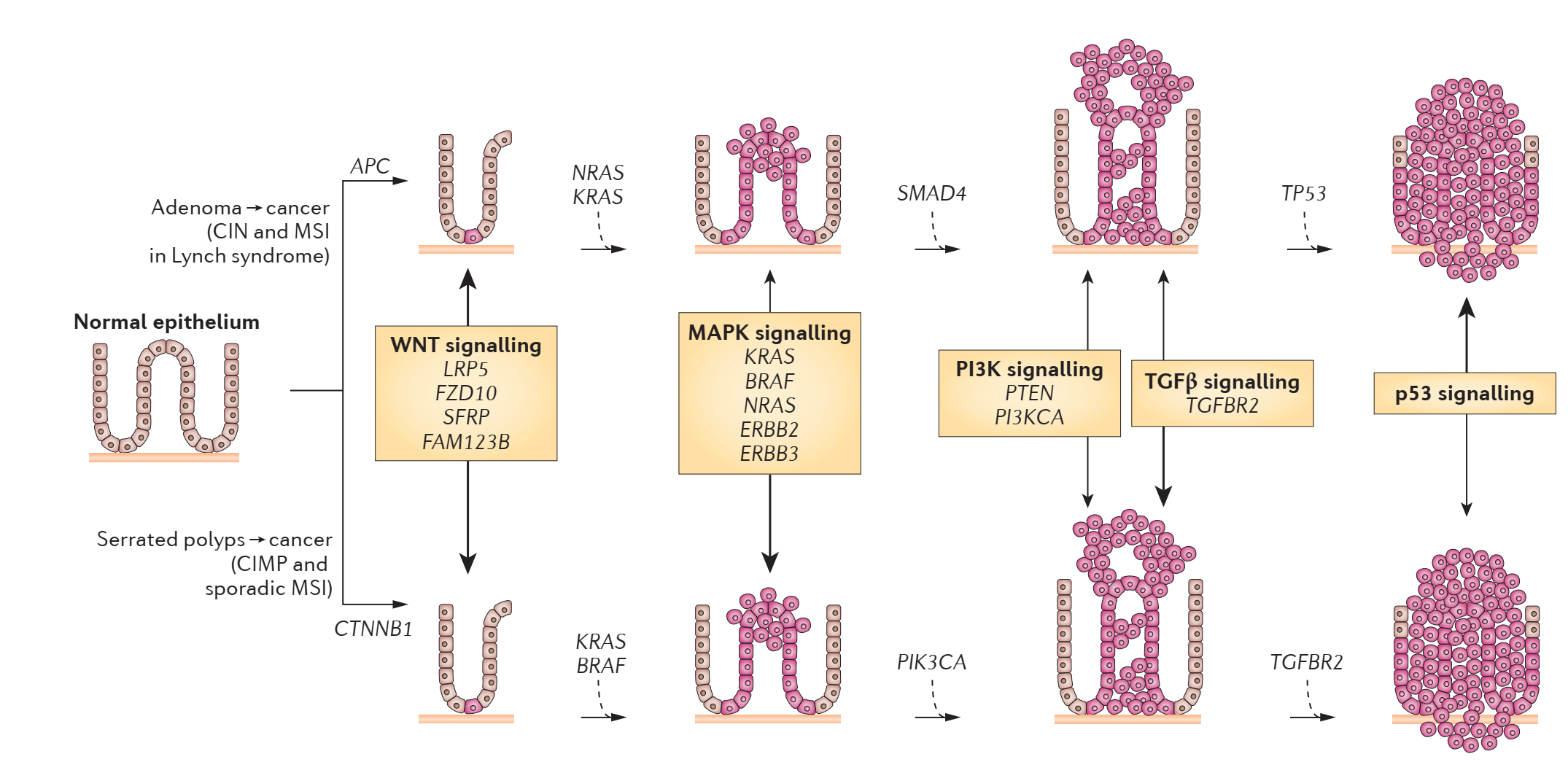
۳. پیشرفت از پولیپ به سرطان: دو مسیر کلاسیک و سرشتی
مسیر کلاسیک
بیشتر سرطانهای کولورکتال از پولیپها نشأت میگیرند و مراحل پیشرفت زیر را طی میکنند:
- کانونهای کریپت غیرطبیعی: ضایعات اولیه که میتوانند به آدنوم تبدیل شوند.
- آدنوم اولیه: پولیپهای کوچک (کمتر از ۱ سانتیمتر) با هیستولوژی لولهای یا لولهای-ویلوز.
- آدنوم پیشرفته: پولیپهای بزرگتر (بیش از ۱ سانتیمتر) با هیستولوژی ویلوز.
- سرطان کولورکتال: مرحله نهایی که معمولاً ۱۰ تا ۱۵ سال طول میکشد، اما در شرایط خاص (مانند سندرم لینچ) میتواند سریعتر پیشرفت کند.
مسیر سرشتی
برخی از سرطانهای کولورکتال از پولیپهای سرشتی نشأت میگیرند که حدود ۵ تا ۱۰ درصد از کل پولیپها را تشکیل میدهند. این پولیپها مسیر مولکولی و هیستولوژیکی متمایزی را طی میکنند:
- پولیپ هیپرپلاستیک → پولیپ سرشتی سسیل → آدنوکارسینوما.
- پولیپهای سرشتی در روده راست (سکوم، کولون صعودی و کولون عرضی) اغلب ناپایداری میکروساتلایت (MSI) و فنوتیپ متیلاسیون CpG (CIMP) را نشان میدهند، در حالی که پولیپهای سرشتی در روده چپ (کولون نزولی، سیگموئید و رکتوم) معمولاً پایدار از نظر میکروساتلایت هستند اما ممکن است جهشهای KRAS را داشته باشند.
۴. زیرگروههای مولکولی سرطان کولورکتال
سرطان کولورکتال بر اساس ویژگیهای مولکولی به چهار زیرگروه تقسیم میشود:
- ناپایدار میکروساتلایت (MSI): با نرخ جهش بالا به دلیل نقص در ترمیم ناهماهنگی DNA.
- پایدار میکروساتلایت (MSS): تومورهایی با نرخ جهش بالا اما پایدار از نظر میکروساتلایت.
- پایدار میکروساتلایت یا ناپایدار کروموزومی: تومورهایی با ناپایداری کروموزومی اما پایدار از نظر میکروساتلایت.
- سرطانهای CIMP: تومورهایی با متیلاسیون گسترده CpG، اغلب مرتبط با پولیپهای سرشتی.
۵. جهشهای کلیدی و مسیرهای سیگنالینگ
جهشهای شایع
جهشهایی در ژنهایی مانند APC، CTNNB1، KRAS، BRAF، SMAD4، TGFBR2، TP53، PIK3CA، ARID1A، SOX9 و ERBB2 به طور مکرر در سرطان کولورکتال مشاهده میشوند. این جهشها مسیرهای سیگنالینگ کلیدی را مختل میکنند، از جمله:
- مسیر WNT–β-catenin: اغلب به عنوان مسیر آغازگر در سرطان کولورکتال عمل میکند.
- مسیر RAS–RAF–MAPK: در تکثیر و بقای سلول نقش دارد.
- مسیر PI3K–AKT: رشد و متابولیسم سلول را تنظیم میکند.
- مسیر TGFβ: در تمایز و آپوپتوز سلول نقش دارد.
تغییرات اپیژنتیکی
تغییرات متیلاسیون DNA، مانند هایپرمتیلاسیون پروموتر ژنهای سرکوبگر تومور (مانند SEPT9) و هایپومتیلاسیون عناصر تکراری ژنتیکی، به ناپایداری ژنومی و فعالسازی اونکوژنها کمک میکنند.
۶. محیط تومور و میکروبیوتای روده
محیط تومور
میکروبیوتای روده و وضعیت التهابی بافت مجاور نقش مهمی در تعدیل تشکیل و پیشرفت تومور ایفا میکنند. به عنوان مثال، حضور فوزوباکتریا با سرطانهای CIMP مثبت مرتبط است.
نفوذ ایمنی
نفوذ سلولهای ایمنی در محیط تومور به عنوان یک نشانگر پیشآگهی در کنار مرحلهبندی TNM سنتی شناخته شده است.
۷. ناهمگونی و طبقهبندی مولکولی
ناهمگونی تومور
سرطانهای کولورکتال ناهمگونی قابل توجهی در جهشها نشان میدهند، اما این جهشها اغلب در مسیرهای سیگنالینگ مرتبط خوشهبندی میشوند. این ناهمگونی منجر به طبقهبندی سرطان کولورکتال به زیرگروههای مولکولی با ویژگیهای ژنتیکی و اپیژنتیکی متمایز شده است.
تفاوتهای وابسته به مکان
فراوانی تغییرات مولکولی بسته به محل تومور در روده بزرگ (پروگزیمال در مقابل دیستال) متفاوت است. برخی مطالعات از یک گرادیان تدریجی حمایت میکنند، در حالی که برخی دیگر یک دوگانگی واضح را پیشنهاد میکنند.
۸. نتیجهگیری
سرطان کولورکتال نتیجه تجمع تغییرات ژنتیکی و اپیژنتیکی در سلولهای اپیتلیال روده بزرگ است که توسط عوامل محیطی و ژنتیکی هدایت میشود. این بیماری از طریق مسیرهای متمایز (کلاسیک و سرشتی) پیشرفت میکند و جهشها و مسیرهای سیگنالینگ کلیدی نقش محوری ایفا میکنند. محیط تومور، از جمله میکروبیوتای روده و نفوذ ایمنی، نیز در تشکیل و پیشرفت تومور نقش دارد.
این درک جامع از پاتوفیزیولوژی سرطان کولورکتال پایهای برای توسعه درمانهای هدفمند و استراتژیهای درمانی شخصیسازی شده فراهم میکند.








